RBSE Solutions for Class 12 Biology Chapter 9 एन्जाइम is part of RBSE Solutions for Class 12 Biology. Here we have given Rajasthan Board RBSE Class 12 Biology Chapter 9 एन्जाइम.
Rajasthan Board RBSE Class 12 Biology Chapter 9 एन्जाइम
RBSE Solutions for Class 12 Biology Chapter 9 पाठ्यपुस्तक के प्रश्नोत्तर
RBSE Solutions for Class 12 Biology Chapter 9 बहुविकल्पीय प्रश्न
प्रश्न 1.
एन्जाइम अकार्बनिक उत्प्रेरकों से भिन्न हैं –
(अ) उच्च विसरण दर में
(ब) उच्च ताप पर क्रियाशील
(स) प्रोटीन प्रकृति
(द) अभिक्रिया में स्वयं काम आते हैं।
प्रश्न 2.
एन्जाइम का अप्रोटीन भाग कहलाता है –
(अ) एपोएन्जाइम
(ब) प्रोस्थेटिक समूह
(स) होलोएन्जाइम
(द) उपरोक्त सभी
![]()
प्रश्न 3.
कौन-सा कथन सही है –
(अ) सभी प्रोटीन एन्जाइम होते हैं।
(ब) सभी एन्जाइम प्रोटीन होते हैं।
(स) अधिकांश एन्जाइम प्रोटीन होते हैं।
(द) उपरोक्त में से कोई नहीं
प्रश्न 4.
सर्वप्रथम किस एन्जाइम की खोज की गई थी?
(अ) जाइमेज
(ब) लाइपेज
(स) पेप्सिन
(द) आइसोमरेज
प्रश्न 5.
एन्जाइम सक्रियता प्रभावित होती है –
(अ) pH से
(ब) क्रियाधार सान्द्रता से
(स) तापमान से
(द) उपरोक्त सभी से
प्रश्न 6.
अप्रतिस्पर्धी निरोधक वे पदार्थ हैं, जो एन्जाइम के –
(अ) सक्रिय स्थलों पर संलग्न हो जाते हैं।
(ब) सक्रिय स्थलों को नष्ट कर देते हैं।
(स) रचनात्मक संघटन में परिवर्तन कर देते हैं।
(द) गुणों में कोई परिवर्तन नहीं करते हैं।
![]()
प्रश्न 7.
किस एन्जाइम का सबसे पहले क्रिस्टलीकरण किया गया था –
(अ) यूरिऐज
(ब) केटेलेज
(स) एमाइलेज
(द) एल्डोलेज
उत्तरमाला
1. (स)
2. (ब)
3. (स)
4. (अ)
5. (द)
6. (स)
7. (अ)
RBSE Solutions for Class 12 Biology Chapter 9 अतिलघूत्तरात्मक प्रश्न
प्रश्न 1.
ताला-चाबी क्रियाविधि परिकल्पना किसने एवं कब प्रस्तावित की थी?
उत्तर
एमिल फिशर (Emil Fisher, 1894)।
प्रश्न 2.
एन्जाइम का प्रोटीन एवं अप्रोटीन भाग क्या कहलाता है?
उत्तर
प्रोटीन वाला भाग ऐपोएन्जाइम (Apoenzyme) कहलाता है एवं अप्रोटीन वाला भाग सहकारेक (Cofactor) कहलाता है।
प्रश्न 3.
एक प्रोटीन रहित एन्जाइम का नाम बताइए।
उत्तर
राइबोजाइम (Ribozyme)।
प्रश्न 4.
प्रोस्थेटिक समूह की परिभाषा दीजिए।
उत्तर
जब सहकारक प्रोटीन के अणु से स्थायी रूप से जुड़ा रहता है, तब इसे प्रोस्थेटिक समूह कहते हैं।
RBSE Solutions for Class 12 Biology Chapter 9 लघूत्तरात्मक प्रश्न
प्रश्न 1.
को-एन्जाइम किसे कहते हैं? एक उदाहरण दीजिए।
उत्तर
जब अप्रोटीन भाग ऐपोएन्जाइम से ढीले अथवा आसानी से पृथक होने योग्य अथवा पुनः संलग्न होने योग्य रूप में अनुबन्धित रहता है, तो इस भाग को सह-एन्जाइम (Co-enzyme) कहते हैं।
उदाहरणार्थ– NAD, NADP, Co-A आदि।
प्रश्न 2.
प्रतिस्पर्धी संदमन से आप क्या समझते हैं? इसे कैसे रोका जा सकता है?
उत्तर
कुछ पदार्थों की आण्विक संरचना, क्रियाधारी अणुओं के समान होती है, इन्हें प्रतिस्पर्धी संदमन या निरोधक कहा जाता है। ये पदार्थ, एन्जाइम के सक्रिय स्थलों पर संलग्न हो जाते हैं। इससे सभी क्रियाधार अणुओं को एन्जाइम से संलग्न होने के लिए स्थान नहीं मिल पाता और एन्जाइम सक्रियता नष्ट हो जाती है। प्रतिस्पर्धी संदमन का उपयोग कुछ जीवाणु जनित रोग के नियन्त्रण के लिए किया जाता है। जीवाणुओं की वृद्धि के लिए फोलिक अम्ल आवश्यक होता है। इसका निर्माण P- अमीनोबेन्जोइक अम्ल से होता है। सल्फा औषधि जैसे सल्फापाइरिडीन एवं सल्फानिलेमाइड आदि तथा P- अमीनोबेन्जोइक अम्ल की आण्विक संरचना समान होती है। अतः सल्फा-औषधि, एन्जाइम के सक्रिय स्थल से जुड़ जाती है। P-अमीनोबेन्जोइक अम्ल, एन्जाइम के सक्रिय स्थल से संलग्न नहीं हो पाता जिससे फोलिक अम्ल का संश्लेषण रुक जाता है, जो जीवाणुओं के लिए घातक सिद्ध होता है।
![]()
प्रश्न 3.
एन्जाइम के नामकरण विधि को संक्षेप में समझाइए।
उत्तर
एन्जाइम के नामकरण की पद्धति को क्रियाधार के आधार पर एवं रासायनिक क्रिया के आधार पर दो वर्गों में विभाजित किया गया है।
- क्रियाधार के आधार पर – इस पद्धति के अनुसार, एन्जाइमों का नामकरण, उनके क्रियाधार के अन्त में ‘एस (Ase)’ प्रत्यय (Suffix) लगाकर किया जाता है।
उदाहरणार्थ– सुक्रोज, माल्टेज, लाइपेज जो क्रमशः शर्करा, माल्ट तथा लिपिड्स पर क्रियाशील होते हैं। - रासायनिक क्रिया के आधार पर – कुछ एन्जाइमों का नामकरण उनकी रासायनिक क्रियाओं के आधार पर किया जाता है – जैसे- डाइपेप्टाइड पर तीन एन्जाइम अलग-अलग रासायनिक क्रिया करते हैं, इस आधार पर एन्जाइमों के नाम डाइपेप्टीडेस (Dipeptidase), डाइएमीनेस (Diaminase), डीकाबॉक्सीलेस (Decarboxylase) होंगे।
प्रश्न 4.
एन्जाइम के द्वारा अभिक्रिया की गति कैसे बढ़ायी जाती है?
उत्तर
एन्जाइम, अभिक्रिया की सक्रियण ऊर्जा (Activation energy) को कम करके अभिक्रिया की गति को तेज कर देते हैं।
RBSE Solutions for Class 12 Biology Chapter 9 निबन्धात्मक प्रश्न
प्रश्न 1.
एन्जाइम की संरचना का वर्णन कीजिए तथा इनकी प्रमुख विशेषताओं को समझाइए।
उत्तर
एन्जाइमों की संरचना (Structure of Enzymes) – सभी एन्जाइम प्रोटीन होते हैं परन्तु सभी प्रोटीन एन्जाइम नहीं हैं। राइबोजाइम (Ribozyme) नामक एन्जाइम RNA का बना होता है जो RNA समबंधन (Splicing) में सहायक होता है। कुछ एन्जाइम जैसे पेप्सिन, युरिएज आदि पूर्ण रूप से प्रोटीन द्वारा निर्मित होते है, लेकिन अधिकांश एन्जाइमों में मुख्य घटक प्रोटीन के साथ अप्रोटीन पदार्थ भी पाये जाते हैं, जो प्रोटीन भाग की क्रियाशीलता के लिए आवश्यक होते हैं। इस प्रकार का एन्जाइम होलोएन्जाइम (Holoenzyme) या पूर्ण एन्जाइम कहलाता है। होलोएन्जाइम के प्रोटीन भाग को एपोएन्जाइम (Apoenzyme) तथा प्रोटीन प्रकृति से भिन्न पदार्थ को सहकारक (Cofactor) कहते हैं।
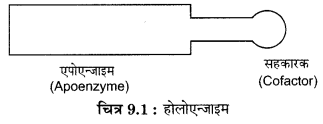
सहकारक तीन प्रकार के होते हैं –
1. प्रोस्थेटिक समूह
2. सहएन्जाइम
3. धातु आयन या सक्रियक।
- प्रोस्थेटिक समूह (Prosthetic group) – जब सहकारक प्रोटीन के अणु से स्थायी रूप से जुड़ा रहता है, तब इसे प्रोस्थेटिक समूह कहते हैं।
- सहएन्जाइम (Co-enzymes) – जब अप्रोटीन भाग ऐपोएन्जाइम से ढीले अथवा आसानी से पृथक होने योग्य अथवा पुनः संलग्न होने योग्य रूप में अनुबन्धित रहता है तो इस भाग को सहएन्जाइम (Co-enzymes) कहते हैं।
उदाहरणार्थ– NAD, NADP, FAD, Co-A आदि। - धातु आयन या सक्रियक (Activator or metal ion) – जब अप्रोटीन भाग अकार्बनिक प्रकृति का कोई धातु आयन हो, तो उसे सक्रियक कहते हैं। विभिन्न धात्विक आयन्स एन्जाइमों के साथ सहकारक (Cofactor) का कार्य करते हैं।
उदाहरण– कैटालेज एन्जाइम के लिए Fe2+ सहकारक (Co-factor) है। होलोएन्जाइम से सहएन्जाइम को डायलेसिस की प्रक्रिया द्वारा आसानी से पृथक किया जा सकता है।
एन्जाइम की प्रमुख विशेषताएँ –
- एन्जाइम उत्प्रेरकों के रूप में कार्य करते हैं और जीवों में अभिक्रिया की दर को प्रभावित करते हैं।
- क्रियाधारों को उत्पादों में बदलने के लिए एन्जाइम की बहुत सूक्ष्म मात्रा अथवा सान्द्रता की आवश्यकता होती है।
- एन्जाइम ताप परिवर्तन से अत्यधिक प्रभावित होते हैं। एन्जाइमों का अनुकूल ताप 25 – 40° C होता है।
- एन्जाइम उत्प्रेरित अभिक्रियाओं की दर pH परिवर्तन से बहुत प्रभावित होते हैं, प्रत्येक एन्जाइम एक विशेष pH माध्यम में सक्रिय होता है।
- अधिकांश एन्जाइम जल तथा नमक के घोल में घुलनशील होते हैं। कोशीद्रव्य में ये कोलॉइडी विलयन बनाते हैं।
![]()
प्रश्न 2.
एन्जाइम की उत्प्रेरण क्रियाविधि का वर्णन कीजिए।
उत्तर
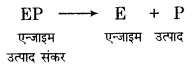
एन्जाइम उत्प्रेरण की क्रियाविधि – आधुनिक धारणा के अनुसार एन्जाइम के कोलॉइडी कणों के पृष्ठ पर निश्चित आकृति के सक्रिय केन्द्र होते हैं, जिनमें उचित आकृति के अभिकारक अणु फिट हो जाते हैं, जैसे-ताले में कुंजी फिट हो जाती है। अत: एन्जाइम और अभिकारक अणु में एक प्रकार से ताला कुंजी (Lock and Key) का सम्बन्ध होता है। पहले एन्जाइम (E) अभिकारक के अणु (S) के साथ सक्रियत संकर (ES) बनाता है और फिर सक्रियत संकर उत्पाद (P) और एन्जाइम (E) में टूट जाता है।
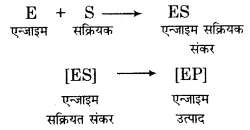
इस प्रकार एन्जाइम, अभिक्रिया को उत्प्रेरित करता रहता है। एन्जाइम उत्प्रेरक सामान्य उत्प्रेरकों के सृदश अभिक्रिया की सक्रियण ऊर्जा (Activation energy) को कम कर देते हैं। एन्जाइम की उपस्थिति में एक नया अभिक्रिया पथ बन जाता है, जिसकी सक्रियण ऊर्जा कम होती है तथा इस पथ में एन्जाइम भी भाग लेता है।
प्रश्न 3.
एन्जाइम के वर्गीकरण को विस्तारपूर्वक समझाइए।
उत्तर
एन्जाइमों का वर्गीकरण (Classification of Enzymes) – अन्तर्राष्ट्रीय जीव रसायन संघ (International Union of Biochemistry (IUB)) ने एन्जाइमों के वर्गीकरण हेतु इनके समग्र औपचारिक अभिक्रिया समीकरण (Overall formal reaction equation) के उपयोग की सिफारिश की थी। एन्जाइम कमीशन ने सभी एन्जाइमों को छः वर्गों में वर्गीकृत किया है व प्रत्येक एन्जाइम को एक एन्जाइम कूट (Enzyme code, EC) की संख्या दी है। ये छः वर्ग निम्न हैं –
- ऑक्सीडोरिडक्टेजेज (Oxidoreductases) – इस वर्ग में ऑक्सीकरण तथा अपचयन की अभिक्रियाओं को उत्प्रेरित करने वाले एन्जाइमों को रखा गया है। ये एन्जाइम अपने क्रियाधारों में से इलेक्ट्रॉन अथवा हाइड्रोजन हटाकर अथवा जोड़कर उनका ऑक्सीकरण अथवा अपचयन करते हैं। जैसे- साइटोक्रोम ऑक्सीडेज, एल्कोहॉल डिहाइड्रोजिनेज, रिडक्टेज।
- ट्रांसफेरेजेज (Transferases) – यह क्रियात्मक दृष्टि से महत्वपूर्ण समूह; जैसे- फॉस्फेट CH, -NH2 आदि का एक अणु, दूसरे अणु में स्थानान्तरण (Transfer) करता है। उदाहरणार्थ– फॉस्फोट्रान्सफेरेस (Phosphotransferase) फॉस्फेट समूह का एक अणु दूसरे अणु में स्थानान्तरण करता है, यह अभिक्रिया श्वसन के समय ग्लूकोस के अपघटन से पूर्व उसे सक्रिय करती है।
- हाइड्रोलाइजेज (Hydrolases) – ये क्रियाधार का जल अपघटन करते हैं; जैसे- एस्टेज (Eseterase), कार्बोहाइड्रेज (Carbohydrase), एमाइलेज (Amylase), न्यूक्लिएजे (Nuclease)।
- लायेजेज (Lyases) – इस प्रकार के एन्जाइम जल को काम में लिये. बिना ही रासायनिक समूहों (Groups) को जोड़ते या हटाते हैं। उदाहरणार्थ– एल्डोलेज (Aldolases)।
- आइसोमरेजेज (Isomerases) – इस प्रकार के एन्जाइम परमाणुओं का पुनर्वितरण करके किसी यौगिक के एक आइसोमर को, दूसरे आइसोमर में बदलते हैं। जैसे- फास्फोहेक्सोआइसोमरेज (Phosphoexoisomerase)।
- लाइगेजेज (Ligases) – इस प्रकार के एन्जाइम दो यौगिकों को सहसंयोजक बंधों द्वारा जोड़ने वाली अभिक्रियाओं को उत्प्रेरित करते हैं। जैसे- पाइरुवेट काबोक्सीलेज (Pyruvate carboxylase)।
प्रश्न 4.
एन्जाइम संदमन किसे कहते हैं? यह कितने प्रकार का होता है एवं इसके प्रभावों को कैसे रोका जा सकता है? स्पष्ट कीजिए।
उत्तर
एन्जाइम निरोधक या संदमन – वे पदार्थ जो एन्जाइम की उत्प्रेरण क्षमता को कम कर देते है, एन्जाइम संदमन कहलाते हैं। ये दो प्रकार के होते हैं
1. प्रतिस्पर्धी निरोधक या संदमन
2. अप्रतिस्पर्धी निरोधक या संदमन
1. प्रतिस्पर्धी निरोधक या संदमन (Competitive inhibition) – कुछ पदार्थों की आण्विक संरचना, क्रियाधारी अणुओं के समान होती है, इन्हें प्रतिस्पर्धी निरोधक कहते हैं। ये पदार्थ एन्जाइम के सक्रिय स्थलों पर संलग्न हो जाते हैं, जिससे एन्जाइम की क्रिया मन्द हो जाती है जैसे- मैलोनिक अम्ल, सक्सीनिक अम्ल का प्रतिस्पर्धी निरोधक है। इस प्रकार के संदमन को क्रियाधार की सान्द्रता में वृद्धि करके रोका जा सकता है।
2. अप्रतिस्पर्धी निरोधक या संदमन (Non-competitive inhibition) – कुछ पदार्थों की आण्विक संरचना यद्यपि क्रियाधार अणुओं के समान नहीं होती है, परन्तु फिर भी ये पदार्थ एन्जाइम के सक्रिय स्थल से न जुड़कर किसी दूसरे स्थान से संलग्न हो जाते हैं, जिससे एन्जाइम के सक्रिय स्थल की आकृति में अन्दर आ जाता है, जिससे क्रियाधार, एन्जाइम के सक्रिय स्थल (Active site) से संयोग नहीं कर पाता है। इस प्रकार अप्रतिस्पर्धी निरोधक (संदमन) एन्जाइम की क्रिया की गति को अवरुद्ध करते हैं।
RBSE Solutions for Class 12 Biology Chapter 9 अन्य महत्वपूर्ण प्रश्नोत्तर
RBSE Solutions for Class 12 Biology Chapter 9 अतिलघूत्तरात्मक प्रश्न
प्रश्न 1.
एन्जाइम शब्द का प्रयोग सर्वप्रथम किसने किया?
उत्तर
कुहने (Kuhne, 1878)
प्रश्न 2.
यीस्ट से जाइमेस नामक एन्जाइम को पृथक किसने किया?
उत्तर
बुकनर (Hans Buchner, 1897)
प्रश्न 3.
एन्जाइम उत्प्रेरण की क्रियाविधि के लिए एमिल फिशर ने कौन-सी परिकल्पना दी?
उत्तर
ताला-कुँजी सिद्धान्त।
प्रश्न 4.
एन्जाइमों का अनुकूलतम ताप कितना होता है?
उत्तर
25°C से 35°C
![]()
प्रश्न 5.
एन्जाइमों के लिए pH परास जिस पर वे सक्रिय रहते हैं? कितना होता है?
उत्तर
5.0 से 7.5 pH पर एन्जाइम सक्रिय रहते हैं।
प्रश्न 6.
सक्रियण ऊर्जा से आप क्या समझते हैं?
उत्तर
किसी अभिक्रिया को आरम्भ करने के लिए आवश्यक न्यूनतम ऊर्जा सक्रियण ऊर्जा कहलाती है।
प्रश्न 7.
एन्जाइम क्रियाधार संकुल से आप क्या समझते हैं?
उत्तर
सभी प्रकार के एन्जाइम (E) सबसे पहले क्रियाधार (S) से मिलकर अस्थायी यौगिक का निर्माण करते हैं, जिसे एन्जाइम क्रियाधार संकुल कहते हैं।
प्रश्न 8.
हाइड्रोलाइजेज के दो उदाहरण दीजिए।
उत्तर
एस्टेज, कार्बोहाइड्रेज।
प्रश्न 9.
होलोएन्जाइम के कितने भाग होते हैं?
उत्तर
होलोएन्जाइम के दो भाग होते हैं –
1. एपोएन्जाइम (Apoenzyme)
2. सहकारक (Cofactor)
RBSE Solutions for Class 12 Biology Chapter 9 लघूत्तरात्मक प्रश्न
प्रश्न 1.
एन्जाइम उत्प्रेरण के दो उदाहरण दीजिए।
उत्तर
1. जाइमेस (Zymase) एन्जाइम ग्लूकोस या फ्रक्टोस का एथिल एल्कोहॉल और कार्बनडाईऑक्साइड में अपघटन को उत्प्रेरित करता है।
![]()
2. माल्टेज एन्जाइम द्वारा माल्टोस का ग्लूकोज में जल अपघटन हो जाता है।
C12H22O11 + H2O → 2C6H12O6
प्रश्न 2.
लाएज (Lyases) पर संक्षिप्त टिप्पणी कीजिए।
उत्तर
इस प्रकार के एन्जाइम जल को काम में लिए बिना ही रासायनिक समूहों को जोड़ते या हटाते हैं।
उदाहरण- कार्बोक्सिलेस (Carboxylase) CO2 को जोड़ते हैं; जैसे- राइबुलोस डाइफॉस्फेट काबॉक्सिलेस।
प्रश्न 3.
कोएन्जाइम को उदाहरण सहित समझाइए।
उत्तर
कोएन्जाइम ऐसे कार्बनिक पदार्थ हैं, जो कुछ एन्जाइमों की सक्रियता के लिए आवश्यक होते हैं, परन्तु एन्जाइम के साथ क्रिया के समय ही अस्थायी रूप से संयुक्त होते हैं। उदाहरण- NAD, NADP आदि।
प्रश्न 4.
अनुकूलन या इष्टतम ताप से आप क्या समझते हैं?
उत्तर
वह तापक्रम जिस पर एन्जाइम सक्रिय होते हैं, इष्टतम या अनुकूलन ताप कहलाता है। 25°C से 35°C तापक्रम एन्जाइम के लिए अनुकूलन तापक्रम होता है।
![]()
प्रश्न 5.
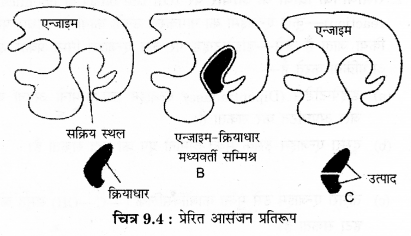
प्रेरित आसंजन सिद्धान्त को समझाइए।
उत्तर
प्रेरित आसंजन सिद्धान्त (Induced fit theory) – इस सिद्धान्त का प्रतिपादन कोशलैण्ड (Koshland, 1966) द्वारा किया गया था। इस सिद्धान्त के अनुसार, एन्जाइम में पाये जाने वाले सक्रिय स्थल की रचना दृढ़ नहीं होती है बल्कि लचीली होती है, प्रारम्भ में सक्रिय स्थल की रचना, क्रियाधार की रचना के अनुपूरक (Complementiy) नहीं होती है, परन्तु जैसे ही क्रियाधार, एन्जाइम के सम्पर्क में आता है तो एन्जाइम के सक्रिय स्थल, क्रियाधार के अनुरूप होने के लिए प्रेरित हो जाते हैं। फलस्वरूप एन्जाईम क्रियाधार सम्मिश्र (Enzyme substrate complex) बन जाता है।
RBSE Solutions for Class 12 Biology Chapter 9 निबन्धात्मक प्रश्न
प्रश्न 1.
एन्जाइम किसे कहते हैं? एन्जाइम क्रिया को प्रभावित करने वाले कारकों का वर्णन कीजिए।
उत्तर
एन्जाइमों की उत्प्रेरण क्रियाशीलता को निम्न कारक प्रभावित करते हैं –
1. तापक्रम (Temeprature) – प्रोटीन प्रकृति के कारण एन्जाइम ताप परिवर्तनों के प्रति अति संवेदनशील होते हैं। जब ताप नियत सीमा (Optimum limit) से ऊपर हो जाता है, तब एन्जाइम की त्रिविम संरचना (Three dimensional structure) तथा सक्रिय स्थलों को समाप्त कर देता है, जिससे एन्जाइम की सक्रियता समाप्त हो जाती है। एन्जाइम क्रिया के लिए अनुकूल ताप 25°C से 35°C तक होता है, इस सीमा में 10°C तापक्रम में वृद्धि करने पर अभिक्रिया की दर 2 गुने तक बढ़ जाती है। 35°C से अधिक तापक्रम पर तापीय विकृतीकरण के कारण अभिक्रिया की गति मन्द हो जाती है वे अति उच्च तापक्रम पर बन्द हो जाती है।
2. pH मान (pH value) – प्रत्येक एन्जाइम का एक pH मान होता है, जिस पर अभिक्रिया की दर इष्टतम (Optimum) होती हैं। अधिकांश एन्जाइम 5.0 से 7.5 pH की परास में दक्षतापूर्वक कार्य करते हैं। pH के मान में कमी अथवा बढ़ोत्तरी एन्जाइम की क्रियाशीलता को प्रभावित करती है।
3. एन्जाइम की सान्द्रता को प्रभाव (Effect of enzyme concentration) – एन्जाइम किसी अभिक्रिया की दर को उत्प्रेरण द्वारा बढ़ाते हैं। ताप, pH और क्रियाधार सान्द्रण (Substrate concentration) की स्थिर दशाओं में अभिक्रिया का वेग एन्जाइम की उपलब्ध मात्रा के प्रत्यक्ष रूप में आनुपातिक होता है, अर्थात् एन्जाइम की सान्द्रता के बढ़ने के साथ-साथ अभिक्रिया की दर बढ़ जाती है।
4. अन्तिम उत्पाद की सान्द्रता – अन्तिम उत्पाद की सान्द्रता में वृद्धि के कारण एन्जाइम उत्प्रेरित क्रिया में मन्दता आती है वह मन्दता बढ़ते-बढ़ते साम्यावस्था पर क्रिया को बिल्कुल शून्य कर देती है तथा साम्यावस्था के बाद क्रिया विपरीत दिशा में प्रारम्भ हो जाती है।
5. एन्जाइम निरोधक एवं विष (Enzyme inhibitors and poisons) – वे पदार्थ जो एन्जाइम की उत्प्रेरण क्षमता को कम कर देते हैं, उन्हें एन्जाइम निरोधक कहते हैं। ये निरोधक पदार्थ सामान्यतः एन्जाइम के सक्रिय स्थलों से संयोग करके उन्हें निष्क्रिय कर देते हैं। संदमन की अभिक्रिया मुख्यतः दो प्रकार की होती है –
(i) प्रतिस्पर्धी निरोधक (Competitive inhibition) – कुछ पदार्थों की आण्विक संरचना, क्रियाधर (Substrate) अणुओं के समान होती है, इन्हें प्रतिस्पर्धी निरोधक कहते हैं। ये पदार्थ एन्जाइम के सक्रिय स्थलों से संलग्न हो जाते हैं, जिससे एन्जाइम की क्रिया मन्द हो जाती है। जैसे- मैलोनिक अम्ल (COOH-(CH2)2COOH), सम्सीनिक अम्ल का प्रतिस्पर्धी निरोधक है। इस प्रकार के संदमन को क्रियाधार की सान्द्रता में वृद्धि करके रोका जा सकता है।
(ii) अप्रतिस्पर्धी निरोधक (Non-competitive inhibition) – कुछ पदार्थों की आण्विक संरचना यद्यपि क्रियाधार (Substrate) अणुओं के समान नहीं होती है, परन्तु फिर भी ये पदार्थ एन्जाइम के सक्रिय स्थल से न जुड़कर किसी दूसरे स्थान से संलग्न हो जाते हैं, जिससे एन्जाइम के सक्रिय स्थल (Active site) की आकृति में अन्तर आ जाता है, जिससे क्रियाधार, एन्जाइम के सक्रिय स्थल (Active site) से संयोग नहीं कर पाता है। इस प्रकार अप्रतिस्पर्धी निरोधक एन्जाइम की क्रिया की गति को अवरुद्ध करते हैं। ऐसे पदार्थ अप्रतिस्पर्धी निरोधक कहलाते हैं। जैसे- सायनाइड (CN) श्वसन क्रिया में आवश्यक साइटोक्रोम ऑक्सीडेस एन्जाइम की क्रियाशीलता को निरोधित (Inhibit) कर देता है। अप्रतिस्पर्धी निरोधक को कोशा विष (Cell poision) भी कहते हैं।
![]()
प्रश्न 2.
निम्नलिखित को स्पष्ट कीजिए
I. ऐपोएन्जाइम
II. होलोएन्जाइम
III. सहएन्जाइम
उत्तर
एन्जाइमों की संरचना (Structure of Enzymes) – सभी एन्जाइम प्रोटीन होते हैं परन्तु सभी प्रोटीन एन्जाइम नहीं हैं। राइबोजाइम (Ribozyme) नामक एन्जाइम RNA का बना होता है जो RNA समबंधन (Splicing) में सहायक होता है। कुछ एन्जाइम जैसे पेप्सिन, युरिएज आदि पूर्ण रूप से प्रोटीन द्वारा निर्मित होते है, लेकिन अधिकांश एन्जाइमों में मुख्य घटक प्रोटीन के साथ अप्रोटीन पदार्थ भी पाये जाते हैं, जो प्रोटीन भाग की क्रियाशीलता के लिए आवश्यक होते हैं। इस प्रकार का एन्जाइम होलोएन्जाइम (Holoenzyme) या पूर्ण एन्जाइम कहलाता है। होलोएन्जाइम के प्रोटीन भाग को एपोएन्जाइम (Apoenzyme) तथा प्रोटीन प्रकृति से भिन्न पदार्थ को सहकारक (Cofactor) कहते हैं।

सहकारक तीन प्रकार के होते हैं –
1. प्रोस्थेटिक समूह
2. सहएन्जाइम
3. धातु आयन या सक्रियक।
- प्रोस्थेटिक समूह (Prosthetic group) – जब सहकारक प्रोटीन के अणु से स्थायी रूप से जुड़ा रहता है, तब इसे प्रोस्थेटिक समूह कहते हैं।
- सहएन्जाइम (Co-enzymes) – जब अप्रोटीन भाग ऐपोएन्जाइम से ढीले अथवा आसानी से पृथक होने योग्य अथवा पुनः संलग्न होने योग्य रूप में अनुबन्धित रहता है तो इस भाग को सहएन्जाइम (Co-enzymes) कहते हैं। उदाहरणार्थ– NAD, NADP, FAD, Co-A आदि।
- धातु आयन या सक्रियक (Activator or metal ion) – जब अप्रोटीन भाग अकार्बनिक प्रकृति का कोई धातु आयन हो, तो उसे सक्रियक कहते हैं। विभिन्न धात्विक आयन्स एन्जाइमों के साथ सहकारक (Cofactor) का कार्य करते हैं।
उदाहरण– कैटालेज एन्जाइम के लिए Fe2+ सहकारक (Co-factor) है। होलोएन्जाइम से सहएन्जाइम को डायलेसिस की प्रक्रिया द्वारा आसानी से पृथक किया जा सकता है।
We hope the given RBSE Solutions for Class 12 Biology Chapter 9 एन्जाइम will help you. If you have any query regarding Rajasthan Board RBSE Class 12 Biology Chapter 9 एन्जाइम, drop a comment below and we will get back to you at the earliest.